Uma observação muito importante é que o lítio, além de reagir violentamente com a água, também reage com o ar e isso faz com que ele se oxide. Essa perda de elétrons se dá porque o oxigênio (um dos componentes do ar) é mais eletronegativo (capacidade de atrair elétrons em ligações químicas) do que o lítio.
1. Como armazenar o lítio?
Utilize óleo de parafina.
2. Por que o lítio quando queimado mostra aquele brilho branco?
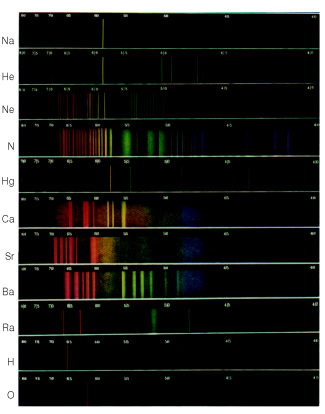
A cor branca é provida pelo seu espectro eletromagnético. Todos os elementos possuem um espectro próprio que pode ser utilizado para sua identificação. É como se fosse a "digital" do átomo. A olho nu alguns desses espectros podem parecer iguais, mas os dados são extremamente detalhados. É importante ressaltar também que existe o espectro contínuo e o discreto (ou descontínuo). O espectro discreto, diferente do contínuo, possui espaçamento entre as cores, chamadas de raias ou bandas.
Digamos que, por exemplo, façamos a luz emitida por um tubo de descarga de gás, preenchido com o gás hidrogênio, passar por um prisma. O espectro obtido seria semelhante ao mostrado abaixo.
Se fosse o gás de outro elemento, o espectro também seria descontínuo, porém, teria um aspecto diferente. Dessa forma, observa-se que de fato, cada espectro serve como uma “digital” para a identificação dos elementos químicos; pois cada um tem um espectro diferente; nunca se repete.
Obs.: O átomo também pode ter o espectro fora da região do visível.
3. Por que o lítio reage "violentamente" com a água?
A reação produzida é a seguinte:
2Li (s) + 2H2O (l) → 2LiOH (aq) + H2 (g)
Portanto, no primeiro vídeo, as bolhas na água são provenientes da produção de hidrogênio. E, mais uma vez, o lítio reage com muita facilidade devido a sua baixa eletronegatividade.